Rumus Fisika Temodinamika
Energi
kekal, tidak dapat dimusnahkan atau diciptakan, tetapi dapat diubah
dari satu bentu ke bentuk yang lain. Kalor adalah salah satu bentuk energi. Kesetaraan kalor dalam termodinamika dirumuskan
1 Kalori = 4,186 Joule= 4,2 Joule
1 Joule = 0,24 Kalori
1 Joule = 0,24 Kalori
Gas yang Dipengaruhi Usaha dari Lingkungannya
Gaya
sebesar F yang diperlukan oleh piston yang mempunyai luas penampang A
untuk menekan gas di dalam ruang tertutup sebesar p dirumuskan
F = pA
Besarnya usaha yang dilakukan oleh gas adalah
F = pA
Besarnya usaha yang dilakukan oleh gas adalah
W = pA (h2-h1)
oleh karena A (h2-h1) adalah volume maka dapat disederhanakan
W = p (V2-V1) atau W = p ΔV
dengan
V1 = volume mula-mula
V2 = volume akhir
ΔV = perubahan volume
W = usaha luar yang diterima
p = tekanan gas
W = p (V2-V1) atau W = p ΔV
dengan
V1 = volume mula-mula
V2 = volume akhir
ΔV = perubahan volume
W = usaha luar yang diterima
p = tekanan gas
Bila W > 0 → sistem melakukan usaha (V2 > V1)
Bila W < 0 → sistem menerima usaha dari lingkungan (V2 < V1)
Perlu sobat ketahui bahwa usaha luar yang dialami oleh gas ideal ada 4 jenis yaitu:
Bila W < 0 → sistem menerima usaha dari lingkungan (V2 < V1)
Perlu sobat ketahui bahwa usaha luar yang dialami oleh gas ideal ada 4 jenis yaitu:
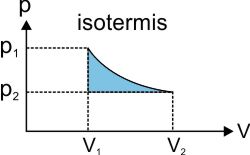
:: Proses Isotermis (Suhu Konstan)
Usaha luar ga (W) sebanding dengan luas daerah di bawah kurva, rumusnya
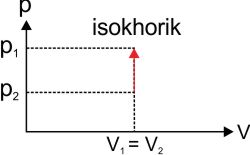
:: Proses Isokhorik (Volume Konstan)
W = p ΔV
karena volume konstan maka ΔV = 0 sehingga
W = 0
W = 0
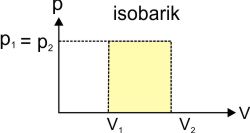
:: Proses Isobarik
W = p ΔV = p (V2-V1)
:: Proses Adiabatik
Yang
dimaksud proses adibatik adalah proses perubahan sistem tqanpa ada
kalor yang masuk atau keluar dari atau ke dalam sistem. Pada proses
adiabatik berlaku persamaan:
p V γ = tetap ; γ = Cp/Cv
γ = tetapan laplace
Cp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
karena
sistem tidak melepas atau menerima kalor maka usaha yang dilakukan oleh
sistem hanya untuk merubah energdalam yang besaranya dapat dirumuskanCp = kalor jenis gas pada tekanan tetap
Cv = kalor jenis gas pada volume tetap
W = 1/(γ-1) x (P1 V1 – P2 V2)
Rumus Menentukan Usaha Luar menggunakan Grafik
Usaha
luar yang dilakukan oleh gas pada tekanan tidak tetap dapat dinyatakan
dalam diagrar p-V, yang besarnya sebanding dengan luas daerah di awah
kurva
a. Proses ke arah kananV2 > V1, berarti W bernilai positif
W = p (V2-V1)
b. Proses Kearah Kiri
V2 < V1, sehingga W bernilai negatifW = -p (V2-V1)
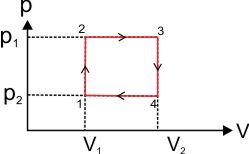
c. Proses Berbentuk Siklus
Proses 1 ke 2 → W = 0Proses 2 ke 3(ke kanan) → W = positif
Proses 3 ke 4 → W = 0
Proses 4 ke 1 (ke kiri) → W = negatif
W Total = Δp x ΔV (p2-p1) x (V2-V1)
Hukum Pertama Termodinamika
Perubahan energi dalam:
Keterangan:
 :Perubahan energi dalam (Joule)
:Perubahan energi dalam (Joule)- U2:Energi dalam pada keadaan akhir (Joule)
- U1:Energi dalam pada keadaan awal (Joule)
- p: Besarnya tekanan (atm)
 : Perubahan volume (liter)
: Perubahan volume (liter)

Penghitungan energi dalam:
- Gas monoatomik:

- Gas diatomik:

PERSAMAAN KEADAAN GAS
Hukum Gay-Lussac
Tekanan tetap → V/T = Konstan → V1/T1 = V2/T2
Hukum Charles
Volume tetap → P/T = Konstan → P1/T1 = P2/T2
Hukum Boyle
Suhu tetap → PV = Konstan → P1V1 = P2V2
P, V, T Berubah (non adiabatis)
(P1V1) / (T1) = (P2V2) / (T2)
Adiabatis
P1V1 γ= P2V2γ
T1V1 γ − 1= T2V2γ − 1
γ = perbandingan kalor jenis gas pada tekanan tetap dan volum tetap → γ = Cp/Cv
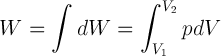
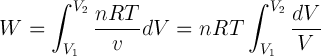
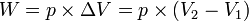
Tidak ada komentar:
Posting Komentar